Tris es un sistema tampón de uso común en experimentos bioquímicos y biológicos, que se ha utilizado ampliamente en biomedicina y otros campos. El equipo de productos de AVT le presentará un conjugado anticuerpo-fármaco (ADC) disponible comercialmente que usa Tris en la formulación, inotuzumab ozogamicina (Besponsa), desarrollada por Pfizer.
Su formulación es la siguiente:
Ingrediente | Inotuzumab ozogamicina | Polisorbato 80 | NaCl | Sacarosa | Trometamina (TRIS) | Agua para inyección | PH |
Contenido | 0,9 mg | 0,36 mg | 2,16 mg | 180 mg | 8,64 mg | 4 ml | Acerca de 8,0 |
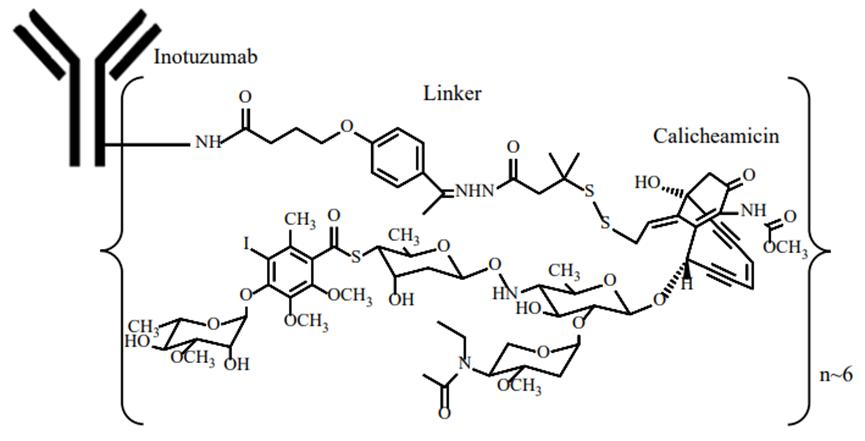
Inotuzumab ozogamicina (Besponsa) es un ADC innovador desarrollado por Pfizer, que consiste en el anticuerpo monoclonal dirigido a CD22 y el agente citotóxico calicheamicina. Besponsa®Está disponible comercialmente en polvo liofilizado, en el que,Sacarosa en ventaActúa principalmente como crioprotector y La trometamina (TRIS) es un tampón de pH.
La inotuzumab ozogamicina es capaz de dirigirse a las células cancerosas y unirse al antígeno CD22 que está presente de forma ubicua en la superficie de las células B. Posteriormente, estos ADC se endocisarán en las células cancerosas y la azitromicina ejercerá aún más su eficacia y causará la muerte de las células cancerosas. Luego, estos ADC se endocisarán en las células cancerosas, donde la caliqueamicina matará aún más las células cancerosas.
El 28 de junio de 2017, BESPONSA fue aprobada para su comercialización en la UE.
Tris USP al por mayorSe utiliza en la producción de Besponsa, que obtuvo la aprobación de la Administración de Drogas y Alimentos DE LOS Estados Unidos (FDA) el 17 de agosto de 2017. Este medicamento está diseñado específicamente para tratar la leucemia linfoblástica aguda (LLA) de células B PRECURSORAS O refractarias en recaída en adultos.En particular, Besponsa es el primer conjugado anticuerpo-fármaco (ADC) aprobado por la FDA dirigido a CD22...
El 22 de diciembre de 2021, Inotuzumab Ozogamicina para inyección (Besponsa), un ADC CD22 desarrollado por Pfizer, fue aprobado oficialmente para su comercialización en China para pacientes adultos con leucemia linfoblástica aguda (LLA) precursora de células B en recaída o refractariaComo el 4THADC aprobado para su comercialización en China...